Dans les eaux naturelles ces trois partenaires sont interdépendants. Seuls la température et les autres ions présents peuvent exercer une influence sur les résultats.
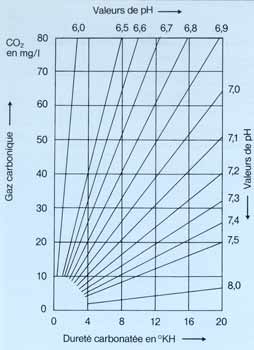
Ce graphique montre donc clairement la relation entre le gaz carbonique, le pH et la dureté carbonatée. Plus la concentration en CO2 augmente, plus le pH et le KH diminuent. Vouloir modifier le pH ou le KH entraîne donc des modifications en cascade des autres éléments.
La surveillance de la qualité de l’eau – alcalinité et dureté :
L’alcalinité se rapporte au montant total de bases dans l’eau exprimée en mg/l de carbonate de calcium équivalent. Une base est une substance qui libère les ions d’hydroxyle (OH) une fois dissoute dans l’eau. Dans la plupart des eaux ces bases sont principalement des ions de bicarbonate (HCO) et des ions de carbonate (CO32-). Ces ions fonctionnent comme des amortisseurs (effet tampon) dans l’eau. Ils protègent l’eau contre les changements soudains du pH. Ils peuvent le faire en absorbant des ions d’hydrogène quand l’eau est acide et en les libérant quand l’eau devient basique.

Les eaux de faible alcalinité (mg/l <20) sont mal protégées, notamment avec la consommation de l’anhydride carbonique (CO2) pendant la photosynthèse, avec une alcalinité de plus de 20 mg/l la capacité tampon est plus grande et empêche les grandes fluctuations dans le pH pendant la photosynthèse.
Voir l’article sur le rapport oxygène, pH
La dureté est la concentration des ions principalement en calcium et magnésium, exprimée en mg/l de carbonate de calcium équivalent. Les valeurs d’alcalinité et de dureté sont normalement de grandeur semblables. Le calcium, magnésium, bicarbonate, et les ions de carbonate dans l’eau naturelle étant prélevés en quantité équivalente dans les dépôts géologiques traversés par l’eau. Cependant, dans quelques eaux l’alcalinité peut excéder sa dureté et vice-versa.
Si l’alcalinité est haute et la dureté basse, le pH peut monter à des niveaux très élevés (10.5) pendant des périodes rapides lors de la photosynthèse. Les eaux sont souvent classées par catégorie selon des degrés de dureté comme suit :
- 0-75 mg/l doux
- 75-150 mg/l modérément durs
- 150-300 mg/l durs
- plus de 300 mg/l très durs
L’alcalinité et la dureté ne sont pas considérablement affectées par l’activité biologique dans le bassin. Les concentrations initiales sont déterminées par les valeurs de l’eau d’approvisionnement. Les changements sont ensuite, en grande partie le résultat des précipitations (pluies acides) et évaporation (concentration des sels minéraux).
Les niveaux souhaitables pour les poissons sont entre 20 et 300 mg/l . Si l’alcalinité totale et la dureté totale sont basses, elles peuvent être augmentées par le chaulage. Cependant, il n’y a aucune manière pratique de diminuer l’alcalinité et de dureté quand ces dernières sont au-dessus des niveaux souhaitables.
En règle générale, les eaux les plus productives pour l’élevage des poissons ont une dureté et une alcalinité approximativement de la même grandeur. Par exemple, une eau avec une alcalinité de 100 mg/l et une dureté de 10 mg/l n’est pas aussi bonne qu’une l’eau possédant une alcalinité et une dureté de 100 mg/l. Cela ne résulte pas directement des niveaux plus élevés de dureté et d’alcalinité intrinsèquement, mais des concentrations plus élevées de phosphore et d’autres éléments essentiels qui augmentent avec la dureté et l’alcalinité.
